Instruções para Realização da Atividade
- Todos os campos acima deverão ser devidamente preenchidos;
- É obrigatória a utilização deste formulário para a realização do MAPA;
- Esta é uma atividade individual. Caso identificado cópia de colegas, o trabalho de ambos sofrerá decréscimo de nota;
- Utilizando este formulário, realize sua atividade, salve em seu computador, renomeie (MAPA – FUNDAMENTOS DE FARMACOLOGIA) e envie em forma de anexo no ambiente Studeo (M.A.P.A);
- Formatação exigida para esta atividade: documento Word ou pdf, Fonte Arial ou Times New Roman tamanho 12, Espaçamento entre linhas 1,5, texto justificado;
- Formatar todo o trabalho, perguntas e respostas;
- Não é necessário apagar nada;
- Ao utilizar quaisquer materiais de pesquisa referencie conforme as normas da ABNT; (Existe um material sobre referências e citações conforme a ABNT disponível em: Arquivos Gerais no ambiente Studeo); incluir as referências bibliográficas no final da atividade;
- Na Sala do Café do ambiente virtual da disciplina você encontrará orientações importantes para elaboração desta atividade. Confira!
- Critérios de avaliação: utilização do template; atendimento ao tema; constituição dos argumentos e organização das ideias; correção gramatical e atendimento às normas ABNT.
- Procure argumentar de forma clara e objetiva, de acordo com o conteúdo da disciplina;
- O formato da atividade a ser enviada pode ser em pdf ou docx.
Em caso de dúvidas, entre em contato com seu Professor Mediador.
Bons estudos!






As principais razões responsáveis pelas falhas no desenvolvimento de novos medicamentos são: baixa biodisponibilidade (39%); ausência de eficácia (29%), detecção efeitos tóxicos (21%); razões de mercado (6%). Em função disso, muitas indústrias farmacêuticas estão fazendo grandes esforços visando encontrar novos usos para os medicamentos já aprovados e/ ou tentando rejuvenescer outros. A lista de descoberta para novos usos dos medicamentos disponíveis no mercado é bastante grande e vem aumentando a cada ano.
Fonte: Calixto e Siqueira Jr. Desenvolvimento de Medicamentos no Brasil: Desafios. Florianópolis-SC, 2008. Disponível em: < http://gmbahia.ufba.br/adm/arquivos/artigo19_2008sup1.pdf> Acesso em: 21 de agosto de 2024.
Considerando as etapas da pesquisa experimental e da pesquisa clínica, o tempo total de desenvolvimento de um novo medicamento pode ultrapassar 10 anos. Podemos dizer que de cada 10.000 moléculas testadas, apenas uma se torna um medicamento que será comercializado.
Fonte: Ministério da Saúde. Fases de desenvolvimento de um novo medicamento, 2022. Disponível em: < https://www.gov.br/inca/pt-br/assuntos/pesquisa/ensaios-clinicos/fases-de-desenvolvimento-de-um-novo-medicamento>. Acesso em: 21 de agosto de 2021.
Como você pode observar o desenvolvimento de fármacos não é tarefa simples e fácil de ser executada, envolve um esforço multidisciplinar. Diversas etapas de trabalho são necessárias para que um medicamento possa ser considerado seguro para uso clínico.
Fonte: Bornia, E. C. S. Fundamentos de Farmacologia. Unicesumar, 2022.
Agora imagine a seguinte situação: Camila, professora da disciplina de Farmacologia do curso de Farmácia, inicia o primeiro semestre com conteúdo de Princípios Gerais da Farmacologia. Em sua primeira aula contempla alguns conceitos que serão uteis para disciplina como remédio, medicamento, fitoterápico, alopáticos entre outros. Ainda ressalva a importância das etapas pelas quais uma substância com potencial terapêutico deve passar, até que a mesma seja comercializada como medicamento. Ao final da aula, para reforçar o assunto abordado em aula, Camila propõe que os alunos elaborem um fluxograma descrevendo as etapas do processo de desenvolvimento de fármacos.
ETAPA I: Idealize que você é um dos alunos da professora Camila e com base no conteúdo teórico disponibilizado na disciplina, você deve seguir os seguintes comandos para realizar a atividade:
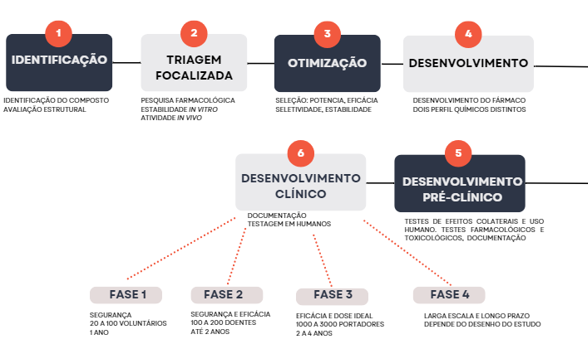
1) CITE e EXPLIQUE todas as 6 etapas que envolvem o desenvolvimento de um fármaco, desde a identificação de estruturas até a disponibilização do medicamento no mercado.
2) DESCREVA as fases que compreendem a etapa 6, quanto aos objetivos, duração e número de pacientes envolvidos.
3) ELABORE um fluxograma com as etapas e fases mencionadas nas questões acima.
ETAPA II: Agora, a Prof Camila sugere que você consulte o site da Agência Nacional de Vigilância Sanitária (ANVISA) para que você possa entender como os medicamentos em fase clínica (etapa 6) estão cadastrados. Para isso siga os passos abaixo:
ACESSE o site:
<https://consultas.anvisa.gov.br/#/ensaiosclinicos/>.
– Em “Nome ou código do medicamento experimental” clique em “Selecione”. Abrindo a aba, em “Pesquisar” escreva: ALXN1720, e selecione o medicamento.
– Clique em “Consultar”.
– Abrindo a página do resultado, clique no nome do medicamento para mais informações.
4) PREENCHA os itens abaixo, conforme o resultado da pesquisa realizada:
a) Medicamento (nome ou código do medicamento):
b) Fase do estudo:
c) Tipo de medicamento experimental:
d) Doença/CID 10:
e) Patrocinador do estudo:
f) Título do estudo:
| CAMPO DE RESPOSTAS (não precisa apagar nada, apenas incluir sua resposta) |
| 1) CITE e EXPLIQUE todas as 6 etapas que envolvem o desenvolvimento de um fármaco, desde a identificação de estruturas até a disponibilização do medicamento no mercado. Etapa 1: Trata-se de identificação do composto ativo, a qual ocorre por meio de procedimento denominado High Trhoughput Screening (HTS) ou triagem de alto rendimento. Nessa etapa, avaliam-se as estruturas de acordo com o alvo terapêutico desejado, podendo determinar a afinidade de ligação entre a substância e o receptor ou ser avaliado por meio de reações celulares e bioquímicas. Etapa 2: Trata-se de triagem focalizada onde faz-se a pesquisa de farmacóforos com alto potencial de atuação sobre o alvo terapêutico pré-determinado, de modo a modificar o percurso da doença. Nessa etapa, avalia-se se as estruturas possuem estabilidade in vitro, atividade em modelo in vivo, seu potencial farmacocinético e segurança do uso. Etapa 3: Refere-se a otimização, onde ocorrem a seleção das substâncias que melhor se ajustam quanto à potência, eficácia, seletividade e segurança em modelos in vivo. Tem como resultado a seleção de moléculas adequadas para testagem em humanos, devendo ser selecionados pelo menos 2 moléculas com perfil químico diferentes entre si. Etapa 4: Etapa onde ocorre o desenvolvimento do fármaco, devendo ter pelo menos 2 farmacóforos selecionados para que ambos possam ser testados em casos onde não há respostas de um deles. Etapa 5: Denominada desenvolvimento pré-clínico, trata-se da realização de testes de avaliação das reações adversas (efeitos colaterais) e riscos do uso por seres humanos. São realizados testes farmacológicos e toxicológicos, bem como preparação de documentos para regulamentação do medicamento e apresentação dos relatórios à autoridade sanitária do país. Etapa 6: É o desenvolvimento clínico. Nessa etapa, são preenchidos os documentos comprobatórios dos resultados pré-clínicos, dados como estrutura do fármaco, mecanismo de ação e possíveis efeitos colaterais, bem como o método de produção e tipo de estudo. Todos os documentos são avaliados e prosseguidas as seguintes fases (fase 1 a 4): fase de avaliação da segurança (fase 1); avaliação da eficácia (fase 2); estabelecimento da eficácia e segurança (fase 3); avaliação em larga escala e a longo prazo (fase 4). |
| 2) DESCREVA as fases que compreendem a etapa 6, quanto aos objetivos, duração e número de pacientes envolvidos. Fase 1: Tem como objetivo avaliar a segurança do fármaco, tendo duração de cerca de 1 ano e a partir do envolvimento de 20 a 100 pacientes voluntários. Fase 2: Objetiva avaliar a eficácia e segurança em um grupo pequeno de indivíduos doentes – de 100 a 200 pacientes -, de forma a determinar a relação dose resposta, durante um período de até 2 anos. Fase 3: Objetiva o estabelecimento da eficácia e dose adequada a ser lançada no mercado farmacêutico. Nessa fase, a amostra de pacientes portadores da doença deve ser estatisticamente significativa, entre 1000 e 3000 voluntários, tendo duração média de 2 a 4 anos. Fase 4: Tem como objetivo avaliar o uso do medicamento em larga escala e a longo prazo na população doente, de forma a também acompanhar novos efeitos colaterais observados. A duração é dependente do desenho do estudo. |
4) PREENCHA os itens abaixo, conforme o resultado da pesquisa realizada:
a) Medicamento (nome ou código do medicamento): ALXN1720.
b) Fase do estudo: fase III.
c) Tipo de medicamento experimental: biológico.
d) Doença/CID 10: miastenia gravis / G700.
e) Patrocinador do estudo: Astrazeneca do Brasil LTDA.
f) Título do estudo: Estudo de fase 3, randomizado, duplo-cego, controlado por placebo, paralelo, multicêntrico para avaliar a segurança e eficácia de ALXN1720 em adultos com miastenia gravis generalizada. Emenda 2.0 de 02 de dezembro de 2022.


![1) O paciente J.S.C., 56 anos, está internado na UTI após complicações com o infarto agudo do miocárdio. Como se encontra intubado e sob ventilação mecânica, é necessário acompanhar os parâmetros ventilatórios e químicos do paciente. Para isso, amostras de sangue arterial são coletadas e analisadas no exame de gasometria. No último exame, os resultados foram pH = 7,27; pCO2 = 18 mmHg; pO2 = 81 mmHg; sO2 = 95%; [HCO3-] = 8 mM. Baseado nos resultados do último exame de gasometria do paciente J.S.C., assinale a alternativa correta. ________________________________________ Alternativas: • a) O paciente J.S.C. apresenta um quadro de alcalemia, em um processo de alcalose metabólica, pois a produção de ácido láctico durante o infarto agudo do miocárdio induziu uma produção excessiva de íon bicarbonato. • b) Devido à acidemia e à hipocapnia, a equipe interpretou o quadro do paciente como acidose respiratória. Para corrigir esse desequilíbrio ácido-base, a frequência respiratória do paciente foi reduzida para aumentar a pCO2. • c) A equipe interpretou os resultados da gasometria como um processo de alcalose respiratória, pois o paciente apresenta reduções da pCO2 e da concentração plasmática de íons bicarbonato. • d) Com o infarto agudo do miocárdio, houve um consumo do CO2 para neutralizar o excesso de ácido láctico produzido pelo miocárdio em anóxia. Por isso, a redução de pCO2 presente na gasometria. • e) Baseando-se nos resultados da gasometria, a equipe interpretou que o paciente apresentava um quadro de acidose metabólica, como pode ser visto pelas reduções da pCO2 e da [HCO3-]. 2) As proteínas são polímeros lineares construídos a partir de unidades monoméricas chamadas de aminoácidos, os quais são unidos ponta a ponta. A sequência dos aminoácidos ligados uns aos outros é chamada de estrutura primária. De maneira notável, as proteínas se dobram espontaneamente em estruturas tridimensionais, determinadas pela sequência de aminoácidos no polímero proteico. A estrutura tridimensional formada pelas pontes de hidrogênio entre os aminoácidos próximos uns dos outros é chamada de estrutura secundária, enquanto a estrutura terciária é formada por interações de longa distância entre os aminoácidos. A função da proteína depende diretamente desta estrutura tridimensional. Portanto, as proteínas são a personificação da transição de um mundo unidimensional de sequências para um mundo tridimensional de moléculas capazes de realizar diversas funções. Muitas proteínas têm estruturas quaternárias, em que a proteína funcional é composta por várias cadeias polipeptídicas. Considerando o texto da questão, analise as seguintes afirmativas: I - A estrutura primária não determina o padrão de dobramento da proteína. II - Nas estruturas terciária e quaternária, as proteínas são funcionais. III - A estrutura tridimensional independe das interações entre os aminoácidos. Considerando as informações apresentadas, é correto o que se afirma em: ________________________________________ Alternativas: • a) I, apenas. • b) II, apenas. • c) III, apenas. • d) I e III, apenas. • e) I, II e III. 3) Os monossacarídeos ou açúcares simples são as menores unidades de açúcar que não podem ser hidrolisadas em carboidratos mais simples. Os monossacarídeos, compostos de função orgânica mista, são constituídos por um esqueleto carbônico de 3 a 7 carbonos. A seguir, uma ilustração da estrutura de dois monossacarídeos. Fonte: elaborado pelo autor. Com base nas informações do texto e da figura, além dos seus conhecimentos sobre o assunto, assinale a alternativa correta. ________________________________________ Alternativas: • a) O monossacarídeo A tem 5 átomos de carbono no esqueleto carbônico e o grupo químico aldoxila. Por isso, o monossacarídeo A é classificado como pentose e aldose. • b) O monossacarídeo B possui 6 carbonos na sua estrutura carbônica e a função orgânica é aldeído. Por isso, o monossacarídeo B é classificado como hexose e aldose. • c) O monossacarídeo A e o monossacarídeo B são hexoses, porém o primeiro é uma aldose, enquanto o segundo é uma cetose. • d) O grupo químico destacado pelo círculo no monossacarídeo A é uma carboxila, por isso, esse açúcar é ácido, um tipo modificado encontrado nos glicosaminoglicanos. • e) O monossacarídeo A e o monossacarídeo B são hexoses, porém o primeiro é uma cetose, enquanto o segundo é uma aldose. 4) Após a fosforilação da glicose, em uma reação catalisada pela enzima hexocinase, a glicose-6-fosfato pode ser utilizada por várias vias metabólicas, como a glicogênese, a oxidação pela via da pentose-fosfato e oxidação pela glicólise. Esta última é a primeira etapa da oxidação completa da glicose para a produção de energia, sendo as duas outras etapas, a oxidação do piruvato e o ciclo do ácido cítrico. A glicólise tem duas fases, a preparatória e de pagamento. Em relação à glicólise, avalie as seguintes asserções e a relação proposta entre elas. I. A glicólise é um conjunto de reações químicas que ocorre apenas nas células eucarióticas e em condições exclusivamente aeróbicas. Na fase preparatória da glicólise, são formadas duas moléculas de ATP, além dos elétrons resultantes da oxidação que são transferidos para formar NADPH. Na fase de pagamento, ocorre gasto de energia para clivagem da glicose para formação de duas moléculas de piruvato. PORQUE II. As reações químicas da glicólise ocorrem no citosol, não necessitando das mitocôndrias nem de oxigênio, por isso essa via metabólica é encontrada em todos os seres vivos, de bactérias aos seres humanos. Na fase preparatória, são usadas duas moléculas de ATP para fosforilação e, portanto, há gasto de energia. Na fase de pagamento, ocorrem a formação de ATP e a transferência de elétrons para NAD+ para formação de NADH. A respeito dessas asserções, assinale a alternativa correta. ________________________________________ Alternativas: • a) As asserções I e II são proposições verdadeiras, mas II não justifica a I. • b) As asserções I e II são proposições verdadeiras e a II justifica a I. • c) A asserção I é uma proposição falsa e a II, verdadeira. • d) A asserção I é uma proposição verdadeira e a II, falsa. • e) As asserções I e II são proposições falsas. 5) Na fosforilação oxidativa, as reações de oxirredução possibilitam o fluxo de elétrons de NADH e FADH2 para o oxigênio. O fluxo de elétrons ocorre em quatro grandes complexos proteicos que estão inseridos na membrana interna da mitocôndria e juntos são denominados cadeia respiratória ou cadeia de transporte de elétrons. Três desses complexos proteicos utilizam a energia liberada pelo fluxo de elétrons para gerar um gradiente de pH e um potencial elétrico transmembrana que, por sua vez, geram a força próton-motriz. Essa força gera um fluxo de prótons, cuja energia é utilizada para formação de ATP. Portanto, a oxidação das fontes energéticas e a fosforilação do ADP para formar ATP são acopladas por um gradiente de prótons através da membrana mitocondrial interna. Considerando as informações apresentadas e os seus conhecimentos sobre o assunto, é correto o que se afirma em: ________________________________________ Alternativas: • a) NADH transfere os seus elétrons para os Complexos I, III e IV, enquanto FADH2 transfere seus elétrons para Complexo II. A partir desses complexos proteicos, os elétrons, após a ativação das bombas de prótons, são transferidos para o gás oxigênio. • b) O gás oxigênio é considerado o aceptor final de elétrons, pois neutraliza os elétrons no final da cadeia respiratória. Porém, em uma situação de anóxia, a ubiquinona e o citocromo c podem atuar como aceptores finais de elétrons para a continuidade da fosforilação oxidativa. • c) O fluxo de elétrons pela cadeia respiratória gera um gradiente eletroquímico de prótons através da membrana interna da mitocôndria que, por sua vez, gera um fluxo de prótons cuja energia é utilizada pela ATP-sintase para a formação de ATP. • d) A atividade de bombas de prótons dos Complexos I, III e IV depende da energia fornecida pelo ATP. Com isso, os elétrons são bombeados para a matriz mitocondrial, para reagirem com o gás oxigênio para a formação da água. • e) O fluxo de elétrons gera um gradiente de pH transmembrana, porém não há diferenças de concentração de prótons entre o espaço intermembranoso e a matriz mitocondrial. Por isso, a força próton-motriz é baixa para a produção de ATP.](https://normasacademicas.com/wp-content/uploads/2025/12/CAPA-25-300x214.png)
Deixe um comentário